Щоб не переривати
навчання під час карантину використовуємо можливості електронних ресурсів.
8В клас
12.03.20.
Розрахунки за
хімічними рівняннями маси, об’єму , кількості речовини реагентів і продуктів
реакції
Наше завдання:
навчитися здійснювати розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції
Пригадайте:
Наше завдання:
навчитися здійснювати розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції
Пригадайте:
1.Навіщо хіміками була введена нова величина «Кількість речовини»?
2. Якими одиницями вимірюється кількість речовини?
3. Якою літерою позначається кількість речовини?
4. Скільки частинок міститься в 1 моль вуглекислого газу?
5. Чому дорівнює стала Авогадро?
6. Скільки атомів міститься в 0,5 моль азоту, у 0,25 моль вуглекислого газу, у 2 моль води?
7. Дайте визначення молярної маси.
8. Що є спільного й відмінного між поняттями «молярна маса» й «відносна молекулярна маса»?
9. Укажіть синонімічні вирази до терміна «стала Авогадро»:
а) число молекул речовини, що міститься в 1 моль;
б) число частинок, що дорівнює 6 × 1023;
в) число молекул речовини, тотожне його відносній молекулярній масі;
г) число атомів хімічного елемента, яке дорівнює його відносній атомній масі.
реакцій маси, кількості речовини та об’єму газу (н. у.) за відомою масою, кількістю речовини, об’єму одного зреагентів чи продуктів реакції, правила вибору і обґрунтування способу розв’язання:
https://www.youtube.com/watch?v=PrJmUrS2Yh8
За зразком розв'язати задачі №1-3 (ІІ варіант) у робочому зошиті на с.83
18.03.20
Фізичні властивості
кислот.Поширеність у природі та використання кислот.Вплив на довкілля і здоров’я
людини
Переглянути відеоурок https://www.youtube.com/watch?v=OAbPt8yP8gk&feature=share&fbclid=IwAR1oNoHr0M5nzBiM3ZLCe5Oy_Yc1khTJM57JX1p0cHteqX3fTzkH8xAnMHs
Перегляньте відеоhttps://www.youtube.com/watch?v=Oq1nWv6-g_k
Демонстрація 9.Зразки кислот https://www.youtube.com/watch?v=sOFVmk6FgmA
Опрацюйте в робочому зошиті с.90
Повторити §32
Перегляньте відеоhttps://www.youtube.com/watch?v=Oq1nWv6-g_k
Демонстрація 9.Зразки кислот https://www.youtube.com/watch?v=sOFVmk6FgmA
Опрацюйте в робочому зошиті с.90
Повторити §32
19.03.20
Тема уроку. Хімічні
властивості кислот: дія на індикатори, взаємодія з металами.Ряд активності металів.Реакції заміщення.
Переглянути відеоурок Хімічні властивості кислот
Перегляньте відео "Дія водних розчинів кислот на індикатори"https://www.youtube.com/watch?v=VZCJIOc4NN0 і заповніть таблицю 1 в робочому зошиті на с.91, дайте відповіді на запитання 1-3.Переглянути відеоурок Хімічні властивості кислот
Перегляньте відео "Реакція кислот з металами"https://www.youtube.com/watch?v=ZlzYUhk9QXA, заповніть за зразком таблицю 2 на сторінці 91 в робочому зошиті
Опрацювати §40
01.04. - 02.04
Опрацювати §40
01.04. - 02.04
Тема
уроку. Хімічні властивості
кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами,
солями. Реакція нейтралізації. Ряд активності
металів. Реакції заміщення
й обміну. Заходи безпеки під час роботи з кислотами.
Перегляньте відео "Реакція кислот з металами"https://www.youtube.com/watch?v=ZlzYUhk9QXA, і запишіть висновки до лабораторного досліду5 (с.92 робочий зошит)
Виконайте тренувальні вправи на с.92-93 у робочому зошиті
Перевірте свої знання Натисніть тут
Перегляньте відео "Реакція кислот з металами"https://www.youtube.com/watch?v=ZlzYUhk9QXA, і запишіть висновки до лабораторного досліду5 (с.92 робочий зошит)
Виконайте тренувальні вправи на с.92-93 у робочому зошиті
Перевірте свої знання Натисніть тут
Домашній
експеримент (виконується за бажанням) Дія на сік буряка чи
червоноголової капусти лимонного соку, оцту, розчину харчової соди, мильного
розчину.
Фотозвіт прикріплюємо на падлет дошку
08.04.20
Тема уроку. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Заходи безпеки під час роботи з лугами
1.Пригадайте класифікацію основ
До розчинних основ належать
гідроксиди лужних металів (LiOH, NaOH, KOH, RbOH, CsOH);
гідроксиди лужно-земельних металів(Ca(OH)2, B
a(OH)2, Sr
(OH)2 ).
Всі інші основи - нерозчинні.
Однокислотні основи містять одну гідроксильну групу: NaOH, CuOH.
Двокислотні основи містять дві гідроксильні групи: Ca(OH)2, Cu(OH)2.
Багатокислотні основи містять більше, ніж дві гідроксильні групи: Fe(OH)3.
2.Виконайте інтерактивну вправу Класифікація основ
Хімічні властивості розчинних у воді основ.
Вам відомо, що існують розчинні у воді основи (луги) та нерозчинні. Розглянемо хімічні властивості цих двох груп основ.
1. Дія лугів на індикатори.
Як
і кислоти, луги проявляють здатність змінювати забарвлення індикаторів.
Дослідимо зміну забарвлення індикаторів у лужному середовищі, виконавши
лабораторний дослід.
2. Взаємодія лугів з кислотними оксидами.
Під
час вивчення кислотних оксидів ви вже ознайомилися з цією властивістю
розчинних у воді основ. Наведемо інші приклади взаємодії лугів а
кислотними оксидами:
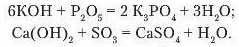
Під час реакцій лугів з кислотними оксидами утворюється новий клас речовин солі й вода.
3. Взаємодія лугів із солями.
Розчинні у воді основи взаємодіють з розчинами солей.
Віртуальний лабораторний дослід 5 ВЗАЄМОДІЯ ЛУГІВ ІЗ СОЛЯМИ
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Дані реакції лежать в основі добування нерозчинних основ.
4. Взаємодія лугів із кислотами.
Віртуальний лабораторний дослід 6. ВЗАЄМОДІЯ ЛУГІВ З КИСЛОТАМИ В РОЗЧИНІ
Реакції між основою і кислотою з утворенням солі та води називаються реакціями нейтралізації.
Дійсно,
у процесі перебігу реакції кислота нейтралізувала луг. Реакції
нейтралізації мають практичне застосування. У побуті, коли на шкіру
потрапляє кислота, уражене місце промивають проточною водою і
нейтралізують слабким розчином лугу.
Ca(OH)2 + H2CO3 = CaCO3 + 2H2O
(За матеріалами сайту Дистанційне вивчення хімії)
Після опрацювання матеріалу і перегляду відео заповніть с. 85 (внизу)-с.86. в робочому зошиті
09.04.2020
Тема уроку.Хімічні властивості нерозчинних основ: взаємодія з кислотами і розкладання внаслідок нагрівання
1.Пригадайте хімічні властивості лугів:

2.Перегляньте відео, назвіть вихідні речовини і продукти реакції:
Щоб дослідити купрум(ІІ) гідроксид, отримаємо його дією лугу на розчинну сіль купруму(ІІ).
СuSO4 + 2NaOH = Сu(OH)2 ↓+ Na2SO4
Купрум(ІІ)
гідроксид – основа, практично нерозчинна у воді, тому фенолфталеїн не
змінює забарвлення. При нагріванні купрум(ІІ) гідроксид розкладається на
два оксиди: чорний купрум(ІІ) оксид і воду.
Сu(OH)2 = СuO + H2O
На
прикладі купрум(ІІ) гідроксиду ми переконалися в тому, що нерозчинні
основи при нагріванні розкладаються на оксид металу і воду.
15.04.20
Тема уроку.Хімічні властивості амфотерних гідроксидів : взаємодія з кислотами, лугами ( в розчині, при сплавлянні)
1.Перегляньте відеоурок https://www.youtube.com/watch?v=LKu2gAJrpT0
2.Опрацюйте параграф 39, виконайте тренувальні вправи №1-4с.89 роб.зошит)
16.04.20
Тема уроку. Фізичні та хімічні властивості солей
1.Перегляньте відеоурок https://www.youtube.com/watch?v=eLuUyrDwE1w
2.Уважно перегляньте лабораторний дослід № 6. Взаємодія металів із солями у водному розчині http://interactive.ranok.com.ua/theme/contentview/serednya-ta-starsha-shkola/hmya-8-klas/14050-laboratorn-dosldi/laboratorniyi-dosld-4-vzamodya-metalv-z-solyami-y-vodnomy-rozchin
зробіт звіт про побачене у робочому зошиті на с.96 ( речовини пишіть ті, які ви бачили в відео, можете в зошиті в таблиці замалювати коректором і написати формули речовин, які реагували у відео). Напишіть висновки.
3.Уважно перегляньте лабораторний дослід № 7. Взаємодія солей з лугами у водному розчині
http://interactive.ranok.com.ua/theme/contentview/serednya-ta-starsha-shkola/hmya-8-klas/14050-laboratorn-dosldi/laboratorniyi-dosld-5-vzamodya-soleyi-z-lygami-y-vodnomy-rozchin і оформте звіт на с.96 як у попередньому досліді.
4.Уважно перегляньте лабораторний дослід №8. Реакції обміну між солями в розчині http://interactive.ranok.com.ua/theme/contentview/serednya-ta-starsha-shkola/hmya-8-klas/14050-laboratorn-dosldi/laboratorniyi-dosld-6-reakts-obmny-mzh-solyami-v-rozchin
і оформте звіт на с.97 як у попередньому досліді.
22.04.20
Тема уроку. Хімічні властивості середніх солей
1.Перегляньте відеоурок https://www.youtube.com/watch?v=ljXubEHu5jI&t=76s
2.Використовуючи зразки з відео, виконайте вправи 1, 2, (с.96 у робочому зошиті). Не забувайте враховувати валентності хімічних елементів, коли складаєте формули.
23.04.20
Тема уроку. Хімічні властивості середніх солей
1.Перегляньте відеоурок https://www.youtube.com/watch?v=ljXubEHu5jI&t=76s
2.Використовуючи зразки з відео, виконайте вправи 3,4,5 (с.97у робочому зошиті). Не забувайте враховувати валентності хімічних елементів, коли складаєте формули.
29.04-30.04
Виконання навчальних проектів
З даного переліку оберіть тему 1 навчального проекту, який ви підготуєте у вигляді презентації або реферату і опублікуйте на падлет дошці 8 клас за посиланням http://siteximia.blogspot.com/p/blog-page_14.html
Як публікувати:
1 Готовий проект збережіть на комп'ютері або телефоні
2.Перейдіть за посиланням http://siteximia.blogspot.com/p/blog-page_14.html
3. Оберіть дошку 8 клас
4.Знайдіть на ній рожеве коло з знаком + посередині, натисніть на нього
5.На падлет дошці з'явиться заготовка для публікації(див фото):
6.Замість слова "назва" введіть своє прізвище та ім'я і натисніть стрілочку для завантаження, оберіть місце на комп'ютері чи телефоні, де знаходиться файл з проектом і завантажте його.
7.УСПІХІВ!!!
ТЕМИ НАВЧАЛЬНИХ ПРОЕКТІВ ДЛЯ 8 КЛАСУ:
- Із історії відкриття періодичної системи хімічних елементів.
- Форми Періодичної системи хімічних елементів.
- Хімічні елементи в літературних творах.
- Цікаві історичні факти з відкриття і походження назв хімічних елементів.
- Використання кристалів у техніці.
- Кристали: краса і користь.
- Неорганічні речовини – представники основних класів у будівництві й побуті.
- Хімічний склад і використання мінералів.
- Вплив хімічних сполук на довкілля і здоров’я людини.
Тема уроку. Загальні способи добування оксидів, основ, кислот, солей
1.Перегляньте відеоурок
3.Пройдіть тестування .Форма відкрита до 15 травня https://naurok.com.ua/test/join?gamecode=530543
07.05
Тема уроку .Генетичні зв'язки між основними класами неорганічних сполук
1.Перегляньте відеоурок
13.05
Тема уроку .Генетичні зв'язки між основними класами неорганічних сполук
1.Перегляньте відео
2.Виконайте вправу 1 у зошиті з друкованою основою с.107 (написати рівняння реакцій за схемами хімічних перетворень
Увага !!!Пройдіть тестування https://naurok.com.ua/test/join?gamecode=282957.
Форма активна до 23 -00 19травня
14.05
Тема уроку. Практична робота №2 Дослідження властивостей основних класів неорганічних сполук
Шановні учні, виконуємо практичну роботу за інструктивною карткою на окремих аркушах ( можна роздрукувати) , які потім зберігаємо.
Виконані завдання сфотографувати та фото відправити на електронну пошту dnnovoarhnvk@gmail.com
Термін здачі - до 19.05
Відправляти окремими файлами з надписом Практична робота №2
Для завантаження інструктивної картки натисніть посилання:
20.05
Тема уроку. Практична робота №3.Розв'язування експерементальних задач
Шановні учні, виконуємо практичну роботу за інструктивною карткою на окремих аркушах, які потім зберігаємо.
Виконані завдання сфотографувати та фото відправити на електронну пошту dnnovoarhnvk@gmail.com
Термін здачі - до 23.05
Відправляти окремими файлами з надписом Практична робота №3
Для завантаження інструктивної картки натисніть посилання:
21.05
Контрольна робота
Виконайте завдання https://naurok.com.ua/test/join?gamecode=2259758
Форма активна до 22.05. до 21-00
Кількість спроб -1






Немає коментарів:
Дописати коментар